益生菌群维持肠道健康的分子机制阅读次数 [9118] 发布时间 :2016-04-10
益生菌群维持肠道健康的分子机制
黄东彦,朱剑锋,胡学华,胡学生,周海泳,庞旭,胡文锋
摘要
益生菌的益生效果在过去已经得到大量的动物试验证明,但对于其益生作用的分子机制的研究尚不能完全满足指导实践应用,益生菌制剂的益生效果不稳定、不显著的问题仍存在。近年来大量针对益生菌及肠道细胞、益生菌对致病菌和益生菌对疾病的相互作用机制进行了研究,并取得了一些成果。本文综述了以上三方面作用机制研究的进展。
1前言
人类对于肠道益生菌群的研究历史非常久远,尽管如此,针对肠道健康的发酵产品直到20世纪初才开始深入研究。在诺贝尔奖得主Metchnikoff提出益生菌概念后,益生菌倍受人们关注,研究的方面包括提高消化能力、供给营养、抵御致病菌和菌体自身作为抗体的功能等等。但过去的研究大多处于宏观试验阶段,益生菌的益生机理尚未完全研究清楚,尤其是基因激活调控方面还有广阔的研究空间。而在21世纪初,随着分子生物技术手段的发展,肠道益生菌群的作用机理得到更多的研究,从体内试验转为体外试验,从而对益生菌群与肠道细胞的互相作用机制、益生菌对致病菌的屏障作用等等获得深入的研究成果,本文将对这些新成果进行简述并分析未来的研究方向。
2益生菌群与肠道细胞相互作用机制的研究
对于肠道细胞,由于其组成的复杂性使体外研究长时间处于探索体外培养技术的阶段,而近年来由于肠道细胞培养技术的成熟,研究者们开始针对研究肠道益生菌群和各种不同的细胞间的关系。
2.1益生菌群对肠道上皮细胞的激活作用
肠道上皮表面积约400平方米,且长时间与大量肠道微生物接触,与肠道益生菌群时刻保持接触交流,因此肠道上皮细胞是保持肠道微生态平衡的关键之一(McCole and Barrett, 2007)。对于很多肠道疾病,越来越多的证据证明肠道菌群对调节肠道免疫应答有着重要的作用,例如可能存在某些识别特定微生物成分的基因表达程序可抵御微生物威胁(Sansonetti, 2004),如尾相关同源异型域蛋白(Caudal-relate homeodomain protein, Cdx2)和肝脏核因子1α(hepatic nuclear factor 1α, HNF1α)等(Mitchelmore et al., 2000)。
有研究称存在一类哺乳动物模式识别受体(mammalian pattern recongition receptors, PRRs)可以识别细菌和病毒的外形结构从而激活前炎症代谢途径,其中三种PRRs尤为受关注。一种为类钟形受体(Toll-like receptors, TLRs);另一种为核苷酸结合寡聚域分子(nucleotide-binding oligomerizetion domain molecules, Nod);还有一种为C型外源凝集素(C-type lectins, CLRs)。TLR、Nod和CLRs均具有识别菌体表面蛋白的能力,相比之下,TLR的调节作用更为明显。TLR通常与细胞膜密切相关,一般拥有外露的富亮氨酸重复识别域和胞内白细胞间介素受体(interleukin-0000
1 receptor, IL-1R)识别域,例如TLR4可识别革兰氏阴性菌(G-)细胞壁的脂多糖(LPS),TLR5则可以识别细菌的鞭毛蛋白(flagellin)。而这种识别能力可调节某些代谢途径,如上皮细胞识别TLR2或TLR9的结合体可以增加肠道屏障层的保护作用(Cario et al. 2004)。
通过对TLR系列蛋白的研究,表明TLR与Nod能激活转录因子NF-κB(Nuclear factor κB),从而激活受NF-κB控制的前炎症基因的表达(Dupraz et al., 2000)。Kelly等发现当肠炎沙门菌Salmonella enteritidis被TLR识别后,可通过IkB激酶(IkB kinase, IKK)激活NF-κB,从而使RelA基因表达;同时还发现益生菌群中的多形拟杆菌Bacteroides thetaiotaomicron可减缓炎症基因的过度表达,如图1。
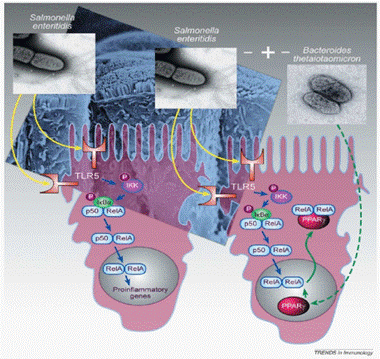
图1 TLR与激活转录因子NF-κB的作用机制(Kelly et al., 2005)
关于TLR和Nod的作用有大量的小鼠动物试验也得到类似的结果,而结果证明TLR对肠道免疫细胞的作用更大,能激活T细胞及Th(T helper)细胞免疫相关的IL-1β和IL-6等。而体外试验方面,菌株与肠道细胞系共培养结合Real time PCR的技术使用较多。Romanin等(Romanin et al., 2010)利用Invitrogen公司的Lipofectamine 2000荧光检测系统转染人源肠道上皮癌细胞系Caco-2,其中的荧光素酶的表达受3X-κB启动子(NF-κB控制的基因之一)控制,和TLR5组合使用可以用于检测可以激活肠道细胞的微生物。通过这种方法筛选出来的24株酵母和23株细菌,再利用Sougioultzis在2006年使用过的细胞接触培养法共培养菌株与重组的Caco-2细胞系,利用小鼠肠道环结扎模型和Real time PCR检测相关益生基因的表达量变化(Sougioultzis, 2006)。结果表明酵母K. Marxianus CIDCA 8154能高效提高荧光蛋白CCL20的表达量,同时很多前炎症因子如IL-1β和TNF-α等的表达量也有大幅度提高,从而表现出菌株对肠道细胞的免疫调节机制。
另外,对于可以减弱肠道发炎症状的诱导型—氧化氮合酶(inducible nitric oxide synthase, iNOS)和发炎调节剂过氧化物酶体增殖激活受体γ(peroxisome proliferators-activated receptor-gamma, PPAR-γ)等也是益生菌免疫调节机制的研究热点,但其作用主要为辅助作用(Zanello et al., 2009)。
而肠道上皮细胞的研究方法已经发展出一些较为成熟的系统:常用的动物肠道细胞系有Caco-2、HT-29、HCT116以及HeLa等;培养基多数选用DMEM或RPMI配合5%-10%小牛血清;检测基因表达的微矩阵基因芯片有人类细胞因子表达矩阵等,而除了常规的粘附培养搭配细胞表面定植培养法,还有半透膜双层隔离共培养法等新技术,减少不确定的复杂成分影响(Maaser et al., 2001),跨细胞上皮电阻法(transepithelial electrical resistance, TER)测定上皮细胞状况反映肠道屏障功能等等(Klingberg et al., 2005)。这些研究技术对于现今得到的成果作出了不少的贡献,是技术瓶颈的突破。
2.2益生菌群对肠道粘膜细胞免疫的促进作用
肠道粘膜是肠道的主要免疫系统区域,其中有系统的淋巴组织如派伊尔氏淋巴集结(Peyer's patch, PP)等起着至关重要的作用。大量研究表明,粘膜细胞分泌的免疫球蛋白SIgA与益生菌群的关系密切(Hapfelmeier et al., 2010);人们也通过对IgA的代谢途径研究益生菌群对肠道粘膜细胞的免疫促进机理,经典的模型如图2。这个模型认为益生菌群激活粘膜细胞中的T细胞与B细胞,使它们表达α4β7 整联蛋白且开始迁移到血液中;同时膜中层的浆细胞(plasma cell)每天分泌3-5g的SIgA抵御肠道致病物质的侵害。
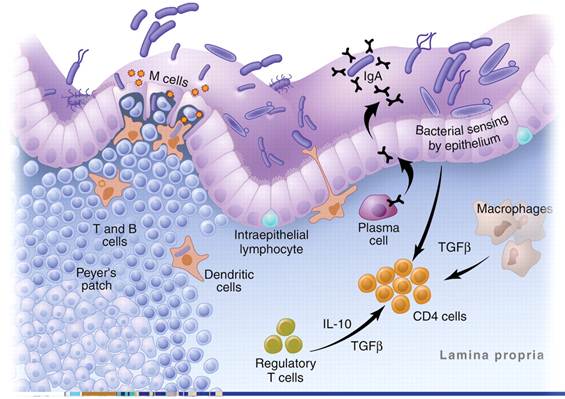
图2 肠道粘膜细胞免疫机制(Thomas et al., 2005)
粘膜细胞中的CD4+ T细胞、CD8+ T细胞、Th17细胞、Treg细胞(Lee, 2010)巨噬细胞(Ivec et al., 2007)、树突状细胞(Dendritic cells, DCs)和嗜酸性细胞等都是人们密切关注的研究对象(Foligne et al., 2007);而上皮内淋巴细胞(intraepithelial lymphocytes, IEL)为最新的热门研究对象,IEL的功能尚未清楚,但很可能与肠道肿瘤监视有关。针对IEL的转基因小鼠体内试验也证明IEL的重要地位,下一步将进行深入的体外试验研究。
2.3益生菌群对肠道细胞的保护作用
益生菌群对肠道损伤的修复作用是研究较为缺乏的方面,但最近Wallace等在2010年研究利用大肠杆菌中的β-葡萄糖醛酸酶抑制剂(β-glucuronidase inhibitor)减轻抗癌药物CPT-11的腹泻副作用时,发现其中一种抑制剂存在保护肠道免受损伤功能(Wallace et al., 2010)。
CPT-11引起腹泻的代谢途径和四种β-葡萄糖醛酸酶抑制剂的结构如图3所示。针对这个代谢途径,β-葡萄糖醛酸酶抑制剂可中断SN-38G转变为引起腹泻的SN-38,动物体内试验的肠道切片透射电子显微照片证明这个方法能有效保护肠道。
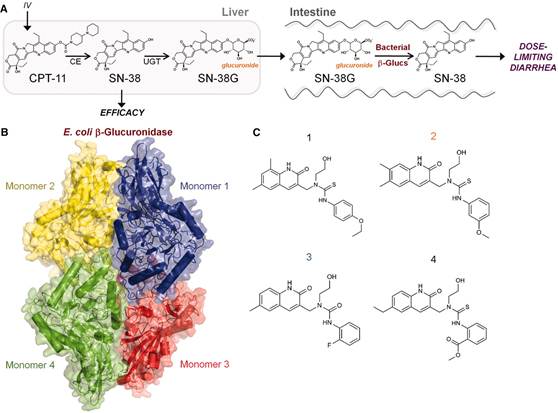
图3 CPT-11引起腹泻的代谢途径及β-葡萄糖醛酸酶抑制剂的结构(Wallace et al., 2010)
另外,Pagnini等也通过研究一种益生菌复合制剂VSL#3(含8种益生菌)的药用功能证明:VSL#3能通过诱导肠道细胞生产TNF-α和激活NF-κB从而保护肠道细胞的绒毛结构完整,同时发现VSL#3可以使肠道菌群结构发生改变,使婴儿双歧杆菌(Bifidobacterium infantis)和噬热链球菌(Streptococcus thermophilus)明显增加,肠道平衡环境更为稳定。另外鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG)的菌毛中发现含有人类粘液结合蛋白,也可能与肠道修复相关(Kankainen et al., 2009)。
对于肠道损伤的防御与修复机制仍然知之甚少,体内试验的影响因素过多,而体外试验难以模拟受损过程,技术上仍有待完善,但益生菌群在这方面的功能一定将会得到更深入的研究。
3益生菌对致病菌的屏障作用
3.1益生菌的强粘附能力竞争抑制致病菌
益生菌在肠道上的强粘附能力一直是益生菌益生作用之一,人们对其研究相对较为深入。益生菌群分泌的一系列粘附成分如脂多糖、多糖A、脂磷壁酸和肽聚糖等能刺激肠道上皮细胞厚度增长,主要包, 括粘蛋白如Muc2表达,同时对多种白细胞间介素基因的表达有抑制和刺激作用。植物乳杆菌(Lactobacillus plantarum 299v)被证实能增加Muc2的表达量且抑制致病菌粘附(Wlodarska, 2010),其原理如图4。微生物相关分子模式(microbe-associated molecular patterns, MAMPs)是益生菌粘附作用的核心,通过这种模式的分子扩散使肠道上皮细胞层中的杯形细胞分泌Muc2蛋白,从而增加益生菌的粘附效果并抵抗致病菌粘附。
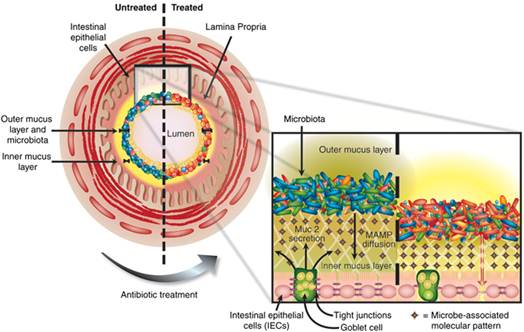
图4 益生菌群粘附作用与抑制致病菌的机制(Wlodarska, 2010)
小鼠体内攻毒试验证明了益生菌的粘附抗菌作用的效果,而且其作用机理也得到较深入的研究,这些成果将对防治肠道炎症疾病提供依据。
3.2益生菌分泌抗菌物质
过去对于益生菌分泌抗菌物质的研究多数为酸性物质,如乳酸、乙酸、丙酸和正丁酸等,以及抗菌肽及胞外多糖。通常我们简单地认为,这些有机酸通过降低肠道pH值而发挥作用。但这种通过降低pH值的机制尚不能很好地解释其代谢产物与致病菌的密切作用。
一种名为表面层蛋白或S层蛋白(Surface layer protein, Slp)的抗菌功能逐渐引起关注。浙江大学的Chen等利用大肠杆菌O157:H7(Escherichia coli O157:H)和鼠伤寒沙门氏菌(Salmonella typhimurium)证明:卷曲乳杆菌ZJ001(Lactobacillus crispatus ZJ001)中的S层蛋白能竞争性驱除致病菌定植肠道(Chen, 2006)。Johnson等在瑞士乳杆菌(Lactobacillus helveticus)中提取S层蛋白也能抵御大肠杆菌O157:H7的定植(Johnson, 2006)。
Konstantinov等发现嗜酸乳杆菌S层蛋白A基因敲除突变株与天然嗜酸乳杆菌对比抗菌能力明显下降,其原因与肠道树突状细胞和T细胞有关,而且通过纯化S层蛋白A经体外试验验证其猜想(Konstantinov et al., 2008)。针对乳杆菌的S层蛋白的研究成果还未能很好地解释其抑制致病菌的机制,但在这些基础上继续进行深入研究也能很好地指导乳酸菌产品的开发与应用。
Fududa等(2011)研究双歧杆菌保护肠道免受致病菌感染的分子机制时发现,双歧杆菌通过产生乙酸预防致病菌感染。一些出现在特定双歧杆菌中的ATP结合卡带式碳水化合物转移子的编码基因可以为试验鼠提供保护,防止小鼠感染大肠杆菌O157:H7致死。这一影响作用至少部分归因于乙酸产量的增加,以及大肠杆菌O157:H7志贺毒素从肠腔到血液的转移途径的中断。作者推测,由提供保护作用的双歧杆菌产生的乙酸改善了肠道由上皮细胞介导的防御作用,从而保护宿主免受致死性感染。
4益生菌群治疗肠道疾病的机制
4.1益生菌群与炎症性肠病的关系
炎症性肠病(inflammatory bowel disease, IBD)是热门研究课题之一,尤其是利用益生菌群防治IBD方面有大量的研究成果。IBD中最为典型的有溃疡性结肠炎(ulcerative colitis, UC)和克罗恩氏病(Crohn’s disease, CD)。益生型大肠杆菌Nissle 1917(Escherichia colistrain Nissle 1917)是研究最为深入的IBD治疗用菌种之一(Rao et al., 2005),在研究其临床应用的过程中证明:它的治疗机制是通过TLR-2识别系统减少促炎细胞因子IL-2、IFN-γ和TNF-α的表达,同时提高IL-10、IL-8和IL-1β的分泌量,而且对于治疗溃疡性结肠炎有显著的效果(Schultz, 2008)。另外前文提到的VSL#3益生菌复合制剂也有治疗克罗恩氏病的报道,Pagnini等利用VSL#3完全防御了SAMP小鼠的克罗恩氏结肠炎攻毒模型,通过RT-PCR检验证明也是与TNF-α和NF-κB有关。
此外,益生菌群中的大肠杆菌分泌的吲哚也有可能是治疗IBD的机制之一。Bansal等发现益生大肠杆菌可将L-色氨酸转变为大量吲哚,通过高浓度的吲哚和群体感应信号分子SdiA(quorum sensing signals)可抑制肠出血型大肠杆菌(enterohemorrhagic E. Coli, EHEC),同时减弱EHEC对肾上腺素和正肾上腺素的趋向性。通过全转录组分析法分析吲哚与HCT-8细胞系的作用发现,紧密连接蛋白、间隙连接蛋白、粘蛋白和50种细胞骨架蛋白的表达量上升,使EHEC的定植率下降,从而减少IBD的伤害(Bansal et al., 2010)。
益生菌群治疗肠道疾病的研究十分丰富,对多种疾病的治疗机理的研究也基本探明,但由于疾病的演变速度很快,防治不同的疾病需要不同的机制,因此仍然需要继续研究,尤其是针对新型致病菌的治疗。
4.2益生菌群与肠道生态失调
肠道生态失调(dysbiosis)是近年倍受重视的一种非感染性疾病,如多发性硬化症(multiple sclerosis, MS)、I型糖尿病(type 1 diabetes, T1D)和风湿性关节炎(rheumatoid arthritis, RA)等。
Wu和Lee提出一个益生菌群与肠道生态的相互作用机制,如图5。其中分节丝状菌(segmented filamentous bacteria, SFB)和脆弱拟杆菌(Bacteroides fragilis)是两个重点关注的对象。该理论认为:分节丝状菌SFB可以激活并增加Th17细胞活性和数量,提高促炎因子的表达;而脆弱拟杆菌可以调节Treg细胞,起到抗炎作用。当分节丝状菌和脆弱拟杆菌处于平衡状态时,促炎因子和抗炎因子的表达量维持在最优状态,免疫系统活性处于稳定的状态,即使加上特异性自身免疫突变(autoimmune-specific mutation)这类引起风湿等疾病的突变,也可以避免疾病发生。但当分节丝状菌这类促炎菌群过多,或者脆弱拟杆菌这类抗炎菌群缺乏等都会引起生态失调(Lee et al., 2010)(图5)。
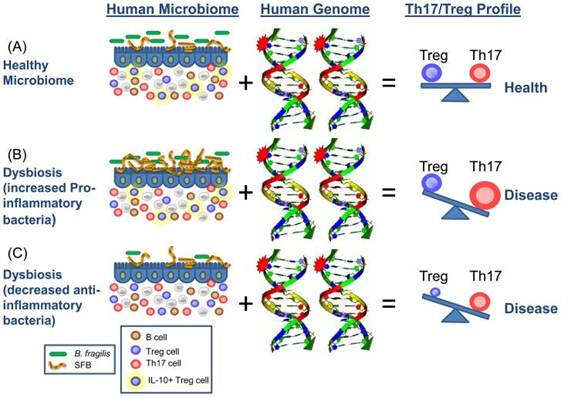
图5 益生菌群与生态失调机制(Lee et al., 2010)
这个机制的理论虽然仍处于初级阶段,但它是一个重要的突破,即益生菌过多或过少都会造成疾病,即对益生菌概念的挑战。只有在益生菌群处于平衡的状态下才可以称为益生菌,否则为中立菌或致病菌。在这个方向需要进行更深入的研究,但这个机制对益生菌的广谱功能有很大的指导作用。
5小结
总体来说,对于益生菌群维持肠道健康的机制的研究已得到较深入的基础成果,过去的宏观机制研究丰富,而近年来的分子机制研究也取得了不少的进展,尤其是肠道特定细胞与特定菌种之间的互作机制研究最为深入,如激活转录因子NF-κB为核心的TLR和Nod等因子的大量研究使益生菌作用于免疫系统的机理得以阐明。
尽管益生菌免疫调节的研究较丰富,但对于益生菌分泌针对肠道细胞的转录因子的研究则鲜有报道。随着研究的深入,人们对益生菌的益生机理将有更深刻的理解。在肠道菌群已被称为“人类的器官”的今天,肠道益生菌群的生态平衡机理有重要的研究价值,益生菌的其他调节机制也需进一步研究,从而指导人们制造出稳定、有效及安全的益生菌制剂。
参 考 文 献(略)
